| Переглянути всі підручники | |||||||||||||
| << | < | 129 | 130 | 131 | 132 | 133 | 134 | 135 | 136 | 137 | 138 | > | >> |
Склад і будова молекул етилену й ацетилену. Існують вуглеводні, що містять Гідрогену ніби менше, ніж це необхідно для насичення чотиривалентності Карбону. Наприклад, у сполуці складу С2Н4 ніби не вистачає двох атомів Гідрогену, а у сполуці складу С2Н2—аж чотирьох атомів Гідрогену. Цією ненасиченістю і пояснюється назва груші сполук — ненасичені вуглеводні.
Звернімося до хімічної будови згаданих речовин.
Особливість її полягає в тому, що атоми Карбону в цих сполуках зв'язані між собою подвійним або потрійним зв'язками.
У молекулі етилену С2Н4 атоми Карбону надають у спільне користування не по одному електрону, як у молекулі стану С2Н6, а по два електрони й утворюють дві спільні електронні пари, тобто два ковалентні зв'язки. По два валентні електрони, що залишились у атомів Карбону, використовуються для зв'язків з атомами Гідрогену.
Електронна та структурна формули етилену:
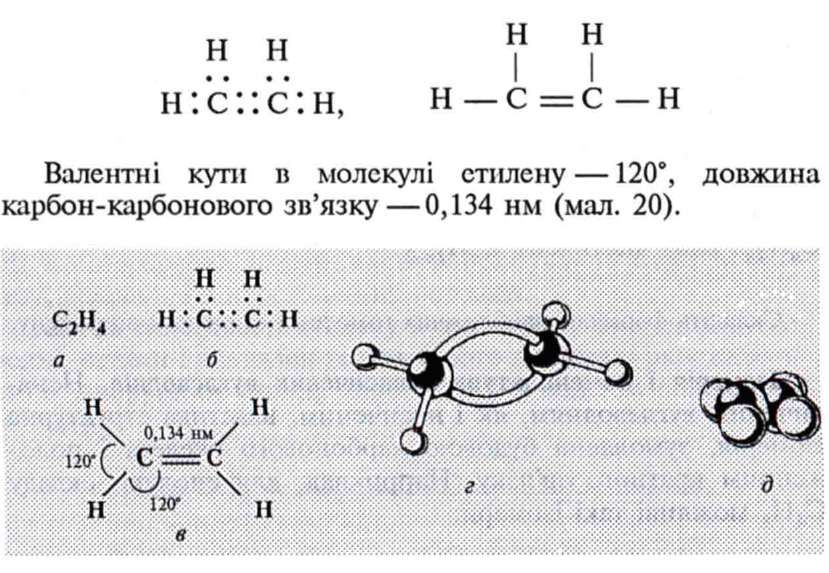 |
|
Мал. 20. Етилен: а — молекулярна формула; б — електронна формула; в — геометрія молекули; г — кулеетержнева модель молекули; д — масштабна модель молекули |
| Переглянути всі підручники | |||||||||||||
| << | < | 129 | 130 | 131 | 132 | 133 | 134 | 135 | 136 | 137 | 138 | > | >> |