| Переглянути всі підручники | |||||||||||||
| << | < | 145 | 146 | 147 | 148 | 149 | 150 | 151 | 152 | 153 | 154 | > | >> |
Але ці формули виявляються неприйнятними, оскільки хімічні властивості бензолу свідчать про рівноцінність атомів Карбону, а в наведених формулах одні атоми зв'язані простими, інші—кратними зв'язками.
У 1865 р. (через 40 років після визначення елементного складу бензсну) німецький учений А. Кекуле запропонував формулу, що найкраще відобразила рівноцінність і атомів Карбону, і атомів Гідрогену:
 |
|
Мал. 25. Масштабна модель молекули бензену |
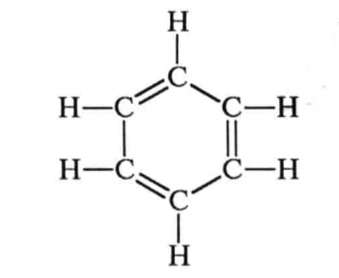
Проте і ця формула неповністю відповідає реальній структурі молекули бензсну. Після з'ясування електронної будови молекули бензсну фюрмулу почали записувати таким чином:
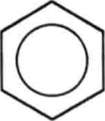
Мається на увазі, що атоми Карбону розміщуються в кутах шестикутника і сполучені з атомами Гідрогену. Кільце всередині шестикутника показує, що в молекулі існує спільна шсстиелектронна хмара, утворена електронами, наданими у спільне користування шістьма карбоновими атомами (по одному електрону кожним атомом).
Зв'язки між атомами Карбону не є простими чи подвійними в чистому вигляді. Через це бензен не належить ні до насичених, ні до ненасичених вуглеводнів, а є представником нової групи —ароматичних вуглеводнів.
Для позначення молекули бензену найчастіше користуються формулою Кекуле, пам'ятаючи про її недосконалість.
| Переглянути всі підручники | |||||||||||||
| << | < | 145 | 146 | 147 | 148 | 149 | 150 | 151 | 152 | 153 | 154 | > | >> |