| Переглянути всі підручники | |||||||||||||
| << | < | 60 | 61 | 62 | 63 | 64 | 65 | 66 | 67 | 68 | 69 | > | >> |
82. На 6,8 г аміаку подіяли хлороводнем. Добутий хлорид амонію розчинили у 200 г води. Масова частка NH4C1 у добутому розчині становить
(а) 9,7 96; (в) 21,4 %
(б) 10,7 % (г) 53,5 %
83. Аміак об'ємом 11,2 л (н. у.) пропустили в розчин, який містить 35 г нітратної кислоти. Визначте маси речовин, що перебувають у розчині після завершення реакції.
§ 13. ПРОМИСЛОВИЙ СИНТЕЗ АМІАКУ
|
У промисловості аміак синтезують із простих речовин азоту N2 і водню Н2: |
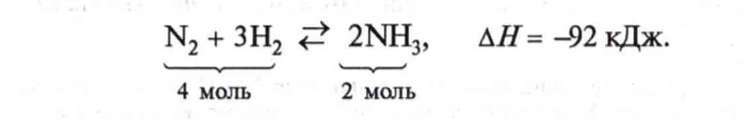 |
За яких умов здійснюється цей синтез, можна дізнатись з рівняння реакції. Але для виробництва цього замало, бо основним завданням є не просто добути аміак, а добути його найбільш економічним способом. Для цього необхідно з'ясувати оптимальні умови синтезу, тобто такі, за яких досягається найбільший вихід аміаку і процес здійснюється з великою швидкістю.
Звернімося до рівняння реакції. Що з нього видно?
Ми бачимо, що: 1) ця реакція є оборотною, отже, до кінця не доходить, у процесі реакції встановлюється хімічна рівновага; 2) реакція відбувається між газами зі зменшенням об'єму; 3) реакція екзотермічна, відбувається з виділенням теплоти.
Як же керувати такою реакцією, пам'ятаючи, що виробництво аміаку має бути економічно вигідним?
Згадаємо теорію, а саме — принцип Лe Шательє: якщо система перебуває у стані рівновага, то в процесі дії на неї сил, що викликають зсув рівноваги, система переходить у такий стан, в якому ефект цього впливу послаблюється.
Виходячи з принципу Ле Шательє, розмірковуємо так: якщо реакція екзотермічна, то треба знизити температуру, щоб аміак не розклався. Але зі зниженням температури
| Переглянути всі підручники | |||||||||||||
| << | < | 60 | 61 | 62 | 63 | 64 | 65 | 66 | 67 | 68 | 69 | > | >> |