| Переглянути всі підручники | |||||||||||||
| << | < | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 | 31 | > | >> |
виробництва, виготовлення люмінофорів (речовин, здатних світитися). Сірку застосовують у виробництві барвників, гуми, чорного пороху, сірників, ліків, використовують її і в сільському господарстві для боротьби зі шкідниками.
12. Які хімічні властивості характерні для кисню і сірки? Наведіть рівняння відповідних реакцій.
13. Порівняйте взаємодію водню з киснем і сіркою. У чому подібність і відмінність цих реакцій?
14. Напишіть рівняння реакцій сірки з киснем і цинком. Яку роль відіграє сірка в одній і в другій реакціях?
15. Який тип хімічного зв'язку у сполуках Сульфуру з металами?
16. Чому кисень виявляє окисні властивості, а сірка, як окисні, так і відновні?
17. Наведіть кілька прикладів рівнянь реакцій, які засвідчують, що у кисню окисні властивості виявляються сильніше, ніж у сірки.
18. Якщо 31 г заліза взаємодіє з сіркою за умови, що масова частка використання заліза становить 90 %, то в результаті реакції утворюється сульфід форуму масою
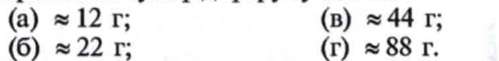
19*. Маючи аналогічну електронну конфігурацію зовнішнього шару, атоми хімічних елементів Оксигену і Полонію різко відрізняються один від одного за властивостями. Як ви гадаєте, чим це можна пояснити?
§ 4. ОКСИДИ СУЛЬФУРУ
Сульфур утворює два кислотні оксиди: оксид сульфуpy(IV) SO2 і оксид сульфуру(VІ) SO3. Різний кількісний склад молекул (і різна їхня будова) зумовлюють відмінні властивості цих речовин.
Оксид сульфуру(ІV) SO2 (діокевд сульфуру, сірчистий газ)—це безбарвний важкий газ (у 2,2 раза важчий за повітря), з різким запахом, що викликає кашель. Негорючий. Дуже легко розчиняється у воді (віл води при 20 °С розчиняється 43 л SO2). Поряд з «фізичним» розчиненням
| Переглянути всі підручники | |||||||||||||
| << | < | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 | 31 | > | >> |