| Переглянути всі підручники | |||||||||||||
| << | < | 24 | 25 | 26 | 27 | 28 | 29 | 30 | 31 | 32 | 33 | > | >> |
Це слід брати до уваги під час виконання дослідів та розв'язування задач.
Усі сульфіти — нерозчинні солі, за винятком сульфітів лужних металів і амонію.
Добування. Оксид сульфуру(IV) добувають спалюванням сірки, а також як побічний продукт випалювання сульфідних руд кольорових металів, наприклад:
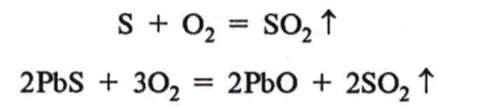
У лабораторних умовах оксид сульфуру(IV) добувають дією кислот на сульфіти. При цьому замість нетривкої сульфітної кислоти виділяється оксид сульфуру(ІV):
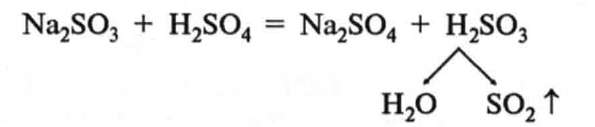
Застосування. Найважливіша галузь застосування оксиду сульфуру(ІV) S02 — це виробництво сульфатної кислоти H2S04. Його використовують також у виробництві сульфітів і гідрогенсульфітів. Сірчистий газ S02 здатний знищувати мікроорганізми і шкідників сільськогосподарських культур, тому його використовують для обкурювання овочесховищ і з метою перевезення ягід і фруктів. Сірчистий газ знебарвлює багато природних фарб, тому з його допомогою вибілюють солому, шовк, вовну та інші матеріали. Застосовують його також для консервування фруктів і ягід та як дезінфі-куючий засіб (для знищення плісені у підвалах, льохах, винних бочках, бродильних чанах).
Фізіологічна дія. Оксид сульфуру(IV) S02 токсичний. Невелика концентрація його у повітрі викликає подразнення слизових оболонок дихальних органів і очей. Тривала дія навіть малих концентрацій оксиду сульфуру(ІV) призводить до виникнення у людини бронхіту, гастриту та інших хвороб, у тому числі, можливо, й раку легенів. Оксид сульфу-py(IV) S02 вважається найнебезпечнішим для здоров'я людини, оскільки викликає загальне ослаблення організму і у поєднанні з іншими забрудниками довкілля спричинює скорочення середньої тривалості життя.
| Переглянути всі підручники | |||||||||||||
| << | < | 24 | 25 | 26 | 27 | 28 | 29 | 30 | 31 | 32 | 33 | > | >> |