| Переглянути всі підручники | |||||||||||||
| << | < | 47 | 48 | 49 | 50 | 51 | 52 | 53 | 54 | 55 | 56 | > | >> |
Елемент Нітроген у вільному стані існує у формі простої речовини—азоту. Молекула азоту двохатомна N2. Атоми Нітрогену об'єднуються один з одним за допомогою трьох електронних пар і утворюють міцний потрійний зв'язок (три ковалентні зв'язки):
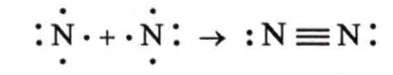
Фізичні властивості. За стандартних умов азот — газ без кольору і запаху. Молекули його неполярні, тому взаємодія між ними слабка, вона не може перешкодити їхньому хаотичному рухові. Цим пояснюється газуватий стан азоту за стандартних умов і це є причиною того, що азот зріджується (-196 °С) і твердне (-210 °С) за дуже низьких температур. У твердому стані має молекулярні кристалічні #ратки. Не полярністю молекул азоту пояснюється його низька розчинність у воді (в 1 об'ємі води за 20 °С розчиняється 0,0154 об'єми азоту). Він трохи легший за повітря, маса 1 л азоту дорівнює 1,25 г.
Хімічний елемент Фосфор, на відміну від Нітрогену, утворює кілька простих речовин, які помітно різняться за властивостями.
Це — білий, червоний і чорний фосфор.
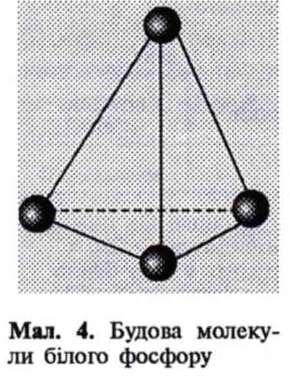
Білий фосфор—м'яка кристалічна речовина, у чистому вигляді зовсім безбарвна і прозора, але зазвичай жовтуватого кольору (схожа на віск), летка, має запах часнику, легкоплавка (tпл.=44°С) і легкозаймиста. Має молекулярні кристалічні ґратки, у вузлах яких розміщені тетраедричні молекули Р4 (мал. 4). У воді не розчиняється. Розчиняється у сірковуглеці CS2 та бензені. У темряві на повітрі світиться зеленкувато-жовтим світлом (люмінесценція), при цьому виділяється теплота (хімічна енергія перетворюється на світлову). Таке явище спричинюється повільним окисненням. Теплота, що виділяється при цьому, може розплавити фосфор і призвести до його займання. Через це білий фосфор зберігають під водою. Під
| Переглянути всі підручники | |||||||||||||
| << | < | 47 | 48 | 49 | 50 | 51 | 52 | 53 | 54 | 55 | 56 | > | >> |