| Переглянути всі підручники | |||||||||||||
| << | < | 50 | 51 | 52 | 53 | 54 | 55 | 56 | 57 | 58 | 59 | > | >> |
57. Якого типу кристалічні ґратки в азоту? На підставі яких фізичних властивостей азоту можна про це робити висновок?
58. Доведіть розрахунком, що азот трохи легший за повітря.
59. Обчисліть густину азоту за воднем.
60. Що таке алотропія? Схарактеризуйте найголовніші алотропні форми Фосфору. Розкрийте причину відмінності їхніх властивостей.
61. Як ви гадаєте, чому азот—газ, а фосфор—тверда речовина?
62. Порівняйте алотропію Оксигену і Фосфору. Що тут спільного і в чому відмінність?
63. Розкрийте фізіологічну роль Нітрогену і Фосфору.
64. У якому вигляді Нітроген і Фосфор зустрічаються в природі і чому?
§ 10. ХІМІЧНІ ВЛАСТИВОСТІ АЗОТУ І ФОСФОРУ
Ви вже знаєте, що в молекулі азоту N2 за рахунок трьох неспарених електронів кожного з атомів утворюється потрійний зв'язок:
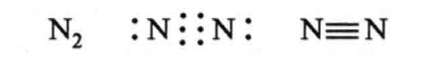
Через це молекула азоту дуже міцна. Потрібно витратити велику кількість енергії на руйнування зв'язку, щоб почалася реакція. Тому молекулярний азот, як правило, вступає в хімічну взаємодію за високих температур.
Фосфор хімічно активніший, ніж азот. Хімічна активність фосфору залежить від алотропної форми. Так, найактивніший білий фосфор. Ви знаєте, що він легко окис-нюється на повітрі і світиться в темряві, може самовільно спалахувати. Червоніш фосфор менш активний. Він окне-нюється під час нагрівання. Ще менш активний—чорний фосфор.
У рівняннях хімічних реакцій білий фосфор звичайно позначають формулою Р4, що відповідає складу його молекули. Червона і чорна алотропні форми фосфору позначаються символом Р. Такий самий символ використовують, коли форма невідома або може бути будь-якою. Це хімічна формула фосфору, умовна для всіх його алотропних форм.
| Переглянути всі підручники | |||||||||||||
| << | < | 50 | 51 | 52 | 53 | 54 | 55 | 56 | 57 | 58 | 59 | > | >> |