| Переглянути всі підручники | |||||||||||||
| << | < | 116 | 117 | 118 | 119 | 120 | 121 | 122 | 123 | 124 | 125 | > | >> |
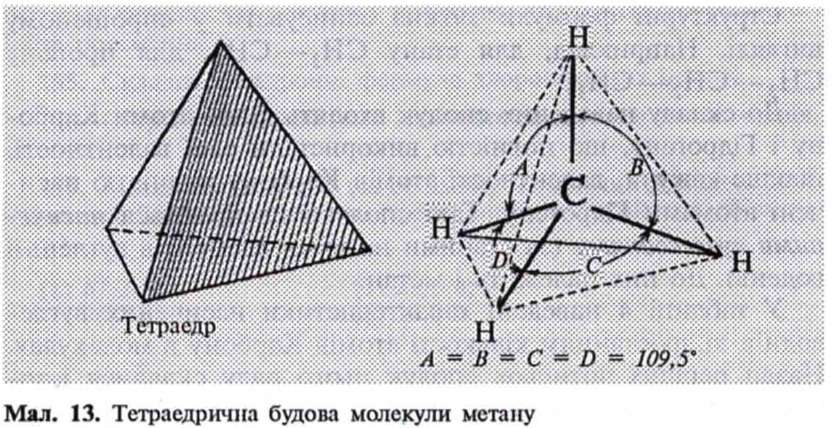
валентні зв'язки спрямовуються під кутом 109,5° до вершин тетраедра, де розміщені атоми Гідрогену (мал. 13).
Тетраедричний напрям зв'язків дає змогу валентним електронам перебувати один від одного на максимальній відстані. Така будова молекули зумовлена електронною будовою атома Карбону і підтверджується фізико-хімічними дослідженнями.
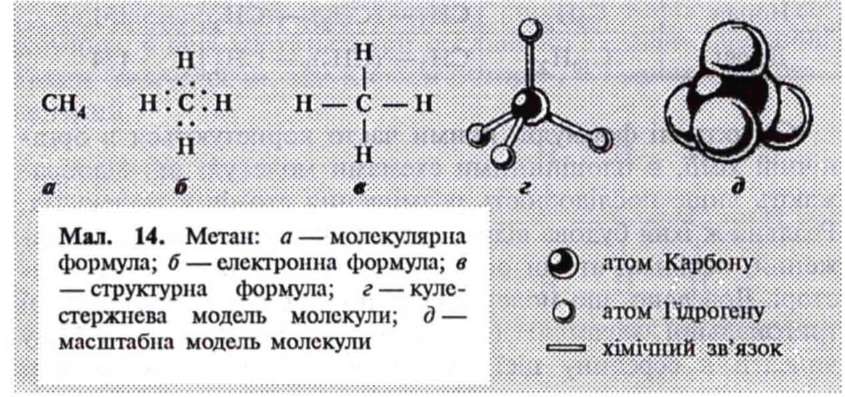
Реальну будову молекул можна передати за допомогою моделей. Для конструювання моделей атоми Карбону і Гідрогену виготовляють у вигляді кульок, а хімічні зв'язки —у вигляді стержнів, тому такі моделі називаються кулестержневими (мал. 14, г; мал. 15, г).
Використовують також масштабні моделі, в яких розміри атомів і зв'язків передаються точніше, пропорційно реальним розмірам молекул (мал. 14, д; мал. 15, д).
| Переглянути всі підручники | |||||||||||||
| << | < | 116 | 117 | 118 | 119 | 120 | 121 | 122 | 123 | 124 | 125 | > | >> |