| Переглянути всі підручники | |||||||||||||
| << | < | 89 | 90 | 91 | 92 | 93 | 94 | 95 | 96 | 97 | 98 | > | >> |
кликати ядуху, тому приміщення, де перебувають люди, треба часто провітрювати.
Чадний газ СО —дуже отруйний. Він утворює стійку сполуку з гемоглобіном крові, внаслідок чого кров втрачає властивість переносити кисень в організмі, і настає кисневе голодування. У людини з'являються сильний головний біль, нудота, вона може знепритомніти і навіть померти!
Особливо небезпечно заводити автомобіль у гаражі за зачиненими дверима... Цс рівнозначно самогубству! Заслонку в печі можна закривати тільки тоді, коли вугілля вже не горить полум'ям, а лише слабко жевріє...
Оксид силіцію(ІV) Si02, або діоксид силіцію,—тверда речовина, кристалічна, безбарвна, тугоплавка = 1728 °С), у воді не розчиняється (пригадайте білий річковий пісок).
Чому ж така велика відмінність у властивостях діоксиду силіцію Si02 і діоксиду карбону С02 (за стандартних умов С02—газ, a Si02—тверда тугоплавка речовина), адже за хімічним складом ці оксиди є аналогами?
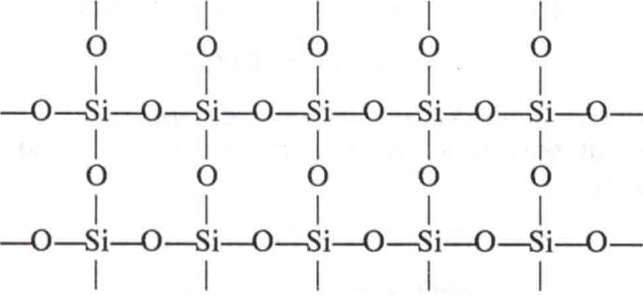
Щоб зрозуміти причину відмінності їхніх властивостей, пригадайте, що властивості речовини залежать від її будови. Отже, причина відмінності властивостей оксиду карбону(ІV) і оксцду силіцію(ІV) полягає у відмінності будови цих речовин. Оксіщ карбону(ГV) складається з молекул С02, тобто має молекулярні кристалічні ґратки, а оксцд силіцію(ІV) — атомні кристалічні ґратки, кожна структурна одиниця яких являє собою тетраедр з атомом Силіцію в центрі та атомами Оксигену по вершинах. Цс можна пояснити тим, що атом Силіцію має більший радіус, ніж атом Карбону. Навколо нього може розміститись не два, а чотири атоми Оксигену, кожний з яких з'єднується з двома атомами Силіцію. Відповідне розміщення атомів можна зобразити на площині схемою:
| Переглянути всі підручники | |||||||||||||
| << | < | 89 | 90 | 91 | 92 | 93 | 94 | 95 | 96 | 97 | 98 | > | >> |