| Переглянути всі підручники | |||||||||||||
| << | < | 87 | 88 | 89 | 90 | 91 | 92 | 93 | 94 | 95 | 96 | > | >> |
У наведеній схемі реакції розставте коефіцієнти іш підставі електронного балансу. Зазначте окисник і відновник.
5. Взаємодія з металами. Під час нагрівання вуглець може взаємодіяти з деякими металами, утворюючи карбіди:
Са + 2С = СаС2
4А1 + ЗС = А14С3
Карбіди —тверді і тугоплавкі речовини. У цих реакціях вуглець виступає як окисник, що для нього не характерно.
Силіцій також виявляє окисні властивості, але лише відносно деяких металів, утворюючи силіциди:
2Mg + Si = Mg2Si,
що для силіцію також не характерно.
6. Взаємодія з воднем. Вуглець може взаємодіяти з воднем. Реакція відбувається під час нагрівання до 500 °С за наявності порошку нікелю як каталізатора:
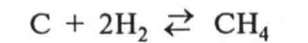
Утворюється органічна сполука—метан СН4 (головна складова частина природного газу).
• Який ступінь окиснення має атом Карбону в молекулі метану СН4? Як ви гадаете, окисником чи відновником у даному разі є вуглець. Чому для нього взаємодія з воднем нехарактерна?
Силіцій з воднем безпосередньо не взаємодіє. Його водневу сполуку SiH4 —силан добувають непрямим способом.
Завдання для самоконтролю
118. Порівняйте хімічні властивості простих речовин — вуглецю і силіцію. Напишіть необхідні рівняння реакцій.
119. Під час спалювання вуглецю масою 187,5 г утворився діоксид карбону об'ємом 336 л (н. у.). Масова частка Карбону у вуглеці становить
(а) 12 %; (в) 48 %;
(б) 24 (г) 96 %.
| Переглянути всі підручники | |||||||||||||
| << | < | 87 | 88 | 89 | 90 | 91 | 92 | 93 | 94 | 95 | 96 | > | >> |