| Переглянути всі підручники | |||||||||||||
| << | < | 90 | 91 | 92 | 93 | 94 | 95 | 96 | 97 | 98 | 99 | > | >> |
Така будова оксиду снліцію(IV) й обумовлює йога високу твердість і тугоплавкість.
Отже, відмінністю у будові кристалічних ґраток пояснюється відмінність властивостей діоксидів карбону й силіцію.
Хімічні властивості
Оксид карбону (ІV) С02 і оксид силіцію (IV) Si02 — солетвірні кислотні оксиди, а оксид карбону(ІІ) CO — несолетвірний оксид.
1. Взаємодія з водою. Якщо у пробірку з водою (1—2 мл) додати 1—2 краплі розчину лакмусу, а потім пустити туди вуглекислий газ, лакмус змінить своє забарвлення, і розчин почервоніє. Це пояснюється тим, що С02 взаємодіє
3 водою з утворенням нестійкої карбонатної кислоти:
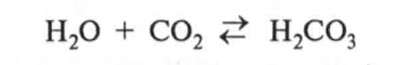 |
|
• Знаючи закономірності зміщення хімічної рівноваги, зазначте, в якому напрямі можна змістити рівновагу в реакції, рівняння якої наведено вище: а) підвищуючи тиск; б) підвищуючи температуру. |
Оксид снліцію(ІV) Si02 хоча й належить до кислотних оксидів, але з водою не реагує. Відповідна йому силікатна кислота H2Si03 утворюється іншим шляхом (вивчатиметься пізніше).
2. Взаємодія з основами і оенбвними оксидами. Оксид карбону(ІV) С02 реагує з лугами у водних розчинах та з твердими лугами і оенбвними оксидами за стандартних умов, утворюючи солі—карбонати:
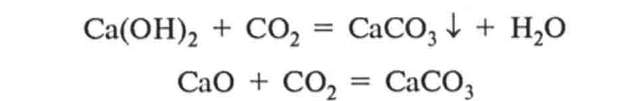
Оксид силіцію(ІV) Si02 взаємодіє з твердими лугами та оенбвними оксидами під час сплавляння, утворюючи солі — силікати:
2NaOH + Si02 = Na2Si03 + Н20 BaO + Si02 = BaSiOj
| Переглянути всі підручники | |||||||||||||
| << | < | 90 | 91 | 92 | 93 | 94 | 95 | 96 | 97 | 98 | 99 | > | >> |