| Переглянути всі підручники | |||||||||||||
| << | < | 86 | 87 | 88 | 89 | 90 | 91 | 92 | 93 | 94 | 95 | > | >> |
2. Взаємодія з киснем. Вуглець легко горить на повітрі. При цьому виділяється велика кількість теплоти, що свідчить про велику міцність зв'язків у молекулі оксиду карбо-ну(ІУ), який утворюється:
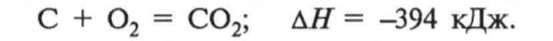
Продукт реакції горіння вуглецю залежить від температури. За порівняно невисоких температур горіння утворюється діоксид карбону С02, а за високих (понад 1000 °С) —поряд з СО, утворюється значна кількість оксиду карбону(ІІ) СО:
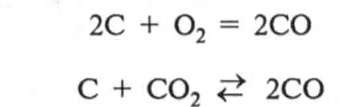 |
|
Оме така реакція (поряд з іншими) відбувається під час спалювання коксу, вугілля, бензину за високої температури та нестачі кисню. Тому вихлопні гази автомобільних двигунів, відхідні гази печей за умови поганої тяги, тютюновий дим обов'язково містять чадний газ СО і забруднюють повітря. |
Силіцій за стандартних умов хімічно стійкий. Але під час сильного нагрівання (понад 400 °С) порошок силіцію згоряє, утворюючи оксид силіцію:
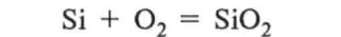
При цьому також виділяється велика кількість теплоти, що свідчить про велику міцність зв'язку між атомами Силіцію й Окснгену.
3. Взаємодія з водою. Якщо на розжарений вуглець подавати водяну пару, то внаслідок реакції утвориться так званий водяний газ —суміш оксиду карбону(ІІ) і водню:
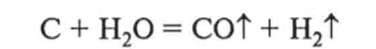
Водяний газ використовують як сировину для синтезу хімічних продуктів.
4. Відношення до лугів та кислот. Вуглець стійкий до дії лугів та кислот. Лише концентровані сульфатна та нітратна кислоти за температури 100°С окиснюють його:
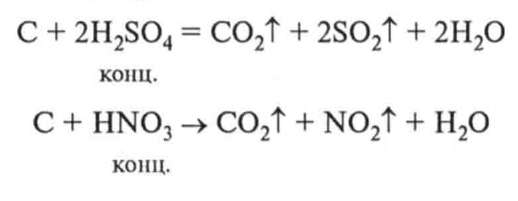
| Переглянути всі підручники | |||||||||||||
| << | < | 86 | 87 | 88 | 89 | 90 | 91 | 92 | 93 | 94 | 95 | > | >> |